TRANSFORMAÇÕES QUÍMICAS
RELAÇÕES ENTRE AS QUANTIDADES ENVOLVIDAS
Muitos dos objetos que utilizamos cotidianamente provêm de indústrias que transformam materiais em produtos. Isso com o objetivo básico de nos auxiliar nas mais variadas tarefas. Para tanto, as transformações químicas envolvidas nesses processos são controladas das mais variadas formas.
Um dos controles básicos diz respeito às quantidades utilizadas e produzidas nas transformações químicas. Esse controle é baseado na Lei da Conservação de Massa, de Antoine Laurent de Lavoisier, e na Lei das Proporções Definidas, de Joseph Louis Proust.
LEI DE LAVOISIER
A Lei de Conservação de Massa é resultante de estudos quantitativos sobre as transformações químicas. O trabalho de Lavoisier foi caracterizado pelo uso sistêmico de instrumentos de medição e controle rigoroso das quantidades dos materiais envolvidos nas transformações químicas.
Entre seus experimentos, destaca-se o estudo com o aquecimento do mercúrio líquido. Ele aqueceu em sistema fechado uma amostra de mercúrio previamente mensurada e observou a formação de um sólido vermelho, o óxido de mercúrio, verificando que a massa do óxido formado era igual à massa inicial dos reagentes. Veja uma representação da reação utilizada por Lavoisier:

Lavoisier registrou em seus trabalhos que existe ainda uma relação entre as massas dos reagentes envolvidas e os produtos, na qual não se podem usar quaisquer quantidades de reagentes para obter uma quantidade arbitrária de produto(s). Ele chegou a essa conclusão a partir de seu experimento envolvendo os gases oxigênio e hidrogênio, para obtenção da água em sistema fechado.
A Tabela 1, a seguir, com dados similares aos adotados por Lavoisier em seus experimentos, pode ajudar no entendimento de sua postulação:
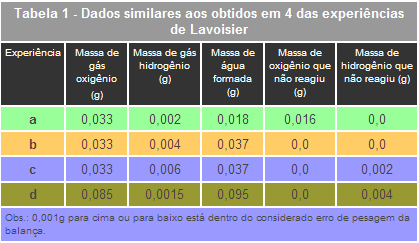
A relação entre reagentes e produtos é verificada nos dados apresentados nos quatro ensaios (a, b, c, d). Considerando a precisão da balança, pode-se afirmar que realmente ocorreu a conservação da massa. Vejamos o caso do experimento b: foram utilizados 0,033 g de gás oxigênio e 0,004 g de gás hidrogênio para produzir 0,037 g de água com nenhuma sobra de reagentes.
Pode-se verificar que a massa de água formada é exatamente o somatório das massas dos dois gases envolvidos. Essa conclusão é reforçada ao observar a experiência c, na qual se utilizou 0,006 g de gás hidrogênio, ao invés dos 0,004 g adotados no experimento b, pois a diferença entre os dois valores, 0,002 g, é o exato valor que sobrou de hidrogênio nessa experiência.
Considerando também o experimento d como referência de análise, verifica-se que para formar 0,095 g de água são necessários 0,085 g de gás oxigênio e 0,011 g de gás hidrogênio, ou seja, dos 0,015 g de hidrogênio utilizados restaram 0,004 g, demonstrando, assim, que existem quantidades especificas dos gases reagentes.
LEI DE PROUST
Em 1799, Joseph Louis Proust, com base no raciocínio da Lei da Conservação das Massas, estabeleceu a Lei das Proporções Definidas (Lei de Proust), segundo a qual um determinado composto químico sempre contém os seus elementos nas mesmas proporções em massa.
Como exemplo pode-se analisar a reação de combustão entre o metal magnésio e o gás oxigênio. Veja a representação:
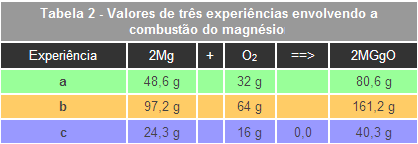
Segundo a Lei de Proust, existe uma proporção definida entre as massas de reagentes para a formação de produtos. Por exemplo, no caso específico da combustão do metal magnésio, representado na Tabela 2, a proporção é constante, mesmo tendo sido utilizadas massas diferentes dos materiais nas três experiências. Vejamos o raciocínio matemático:

A reação de formação do óxido de magnésio apresentará sempre a mesma relação entre magnésio e oxigênio, qualquer que seja a massa formada, ou seja, 1,52 partes de magnésio para 1 parte de oxigênio.
É importante ressaltar que Lavoisier e Proust realizaram seus experimentos com quantidades de materiais possíveis de serem mensuradas nas balanças existentes em suas épocas – e que, atualmente, trabalhos dessa natureza, realizados com balanças de última geração, apontam para a confirmação das duas teorias.
BIBLIOGRAFIA
•GEPEQ – Grupo de Pesquisa em Educação Química. Interações e Transformações I: elaborando conceitos sobre transformações químicas. São Paulo: Ed. EDUSP, 2001.
•LEMBO, A. Química – realidade e contexto: química geral. São Paulo: Editora Ática, 2001.
•VANIN, J. A. Alquimistas e Químicos: o passado, o presente e o futuro. São Paulo: Ed. Moderna, 1999.

